Virologische Analysen im Nationalen Referenzzentrum für Influenzaviren Saison 2023/24
Genetische Charakterisierung der Influenzaviren
Aus Proben des ARE-Praxis-Sentinels (n = 748, blau), des SARI-Krankenhaus-Sentinels (n = 77, rot) sowie aus Proben von anderen Einsendungen (n = 87, lila) wurden 912 Influenzaviren der Saison 2023/24 sequenziert und das Hämagglutinin (HA) genetisch analysiert (Abb. 1). Unter den sequenzierten Influenzaviren gehörten 719 zum Subtyp A(H1N1)pdm09, 47 zum Subtyp A(H3N2) und 146 Viren zur B/Victoria-Linie. Entsprechend ECDC/WHO-Richtlinien wurden die Viren zu Referenzviren und entsprechenden Kladen zugeordnet (Tabelle 1).
BilderstreckeBildVideo
1 / 3

 A(H1N1)pdm09-Viren
A(H1N1)pdm09-Viren
Abb. 1: Phylogenetische Analyse des Hämagglutinin (HA)-Gens von repräsentativen A(H1N1)pdm09-, A(H3N2)- und B/Victoria-Viren aus 2023/24. Die Proben wurden in den Kalenderwochen 06 – 18/2024 entnommen. Die Virusgenome wurden aus Patientenproben vom ARE-Praxis-Sentinel (blau), SARI-Krankenhaus-Sentinel (rot) und von anderen Einsendungen (lila) gewonnen, über Next Generation Sequencing (NGS) sequenziert und die Vollgenome unter www.gisaid.org hinterlegt. Influenzaviren von Patientinnen und Patienten mit einem schweren bis fatalen Verlauf (schwererV), z. B. aufgrund einer Pneumonie und Influenzaviren von geimpften Patientinnen und Patienten (Impfdurchbruch/ImpfD) sind bevorzugt abgebildet. Weiterhin sind Viren mit reduzierter Reaktivität gegenüber dem Impfstoffstamm (reduz. ImpfstammR) dargestellt sowie Viren, die auch nach über sieben Tagen Erkrankung noch in den Patientenproben nachweisbar waren (<ct25/>7T). Darüber hinaus sind ECDC/WHO-Referenzviren und Referenzviren, die für die genetische Zuordnung der zirkulierenden Viren bestimmt wurden, abgebildet. Die abgeleiteten Aminosäuresubstitutionen und Deletionen (-) im HA sind angegeben.
Methode phylogenetische Analyse: Mafft v. 7.520 (Accuracy-based Algorithmus: E-INS-i) für die Erstellung eines Multiplen Sequenz Alignments; Iqtree v. 2.2.2.7 (ML Methode) mit automatischer Selektion des Substitutionsmodels (FLU+I für H0N0, H3N2 und FLU+G4 für H1N1) und 1000 Bootstrap Wiederholungen für die Erstellung der Phylogenie; TreeTime v. 0.11.1 für die Rekonstruktion anzestraler Sequenzen und Annotation der Zweige mit Mutationen.
Tabelle 1: HA-Analyse und Zuordnung der zirkulierenden Influenzaviren in 2023/24 zu Referenzviren und Kladen (ECDC/WHO)
| HA-Referenzviren | GISAID Isolat Accession-Nr. | Klade | n |
|---|
| Gesamt | | | | 912 |
A(H1N1pdm09)
| A/Victoria/2570/2019_Egg | EPI_ISL_417210 | 5a.2 | 0 |
| A/Sydney/5/2021_Cell | EPI_ISL_8767089 | 5a.2a | 651 |
| A/Wisconsin/67/2022_Cell | EPI_ISL_15928563 | 5a.2a.1 | 0 |
| A/Victoria/4897/2022_Egg | EPI_ISL_17072386 | 5a.2a.1 | 68 |
A(H3N2)
| A/Darwin/9/2021_Egg | EPI_ISL_3801278 | 2a | 0 |
| A/Catalonia/NSVH161512067/2022 | EPI_ISL_16043979 | 2a.1b | 0 |
| A/Finland/402/2023 | EPI_ISL_18237981 | 2a.3a | 0 |
| A/Thailand/8/2022 | EPI_ISL_16014504 | 2a.3a.1 | 47 |
| A/Sydney/732/2022 | EPI_ISL_16003445 | 2a.3b | 0 |
| A/Thuringen/10/2022 | EPI_ISL_13704107 | 2b | 0 |
B/Victoria
| B/Washington/02/2019_Egg_ | EPI_ISL_362540 | V1A.3 | 0 |
| B/Austria/1359417/2021_Cell_ | EPI_ISL_983345 | V1A.3a.2 | 0 |
| B/Moldova/2030521/2023 | EPI_ISL_18037429 | V1A.3a.2 | 0 |
| B/Connecticut/01/2021 | EPI_ISL_13912922 | V1A.3a.2 | 30 |
| B/Catalonia/2279261NS/2023 | EPI_ISL_18109004 | V1A.3a.2 | 116 |
nach oben
Antigenetische Charakterisierung der Influenzaviren
In der Saison 2023/24 2023 wurden 319 Influenza A(H1N1)pdm09-Viren, 55 Influenza A(H3N2)-Viren und 130 Influenza B-Viren der Victoria-Linie in Zellkultur isoliert. 165 A(H1N1)pdm09-Virusisolate, sieben A(H3N2)-Isolate und 76 B/Victoria-Virusisolate wurden von anderen Einrichtungen eingesandt und in die antigene Charakterisierung einbezogen. Alle A(H1N1)pdm09-Viren reagierten sehr gut mit dem entsprechenden Referenzserum (Impfstoffvirus A/Victoria/4897/2022; Abb. 2). Da gegenwärtig hauptsächlich A(H1N1)pdm09 Influenzaviren der Clade A/Sydney/5/2021 zirkulieren, wurden die Viren auch gegen dieses Virus getestet. Die Viren reagierten entweder gleich stark oder größtenteils eine log2-Titerstufe höher als mit A/Victoria/4897/2022 (Daten nicht gezeigt). Alle isolierten A(H3N2)-Viren wurden vom gegen den Impfstamm gerichteten Referenzserum (Impfstoffvirus A/Darwin/9/2021) im Hämagglutinationshemmtest gut erkannt, jedoch reagierten die aktuellen Isolate deutlich schwächer als das Impfstoffvirus (Abb. 3). Da A(H3N2) Viren der Klade 2a.3a.1 in den Nachweisen dominierten wurde von der WHO für die nächste Saison ein Impfstoffvirus dieser Klade empfohlen, das A/Darwin/9/2021 ersetzen wird. Die B/Victoria-Viren wurden vom Impfstammantiserum (B/Austria/1359417/2021) ebenfalls detektiert, reagierten aber größtenteils schwächer als das Impfstammvirus (Abb. 4).
Diese Analysen dienen der Untersuchung der Passgenauigkeit der Impfstämme; sie erlauben keine vollständigen Aussagen zur Wirksamkeit der Impfstoffe, da hier noch andere Faktoren berücksichtigt werden müssen (Abstand zur letzten Impfung, Zahl vorangegangener Antigenkontakte, Expositionsdosis, Alter u.a.).

Abb. 2: Reaktivität isolierter A(H1N1)pdm09-Influenzaviren mit gegen den Impfstamm A/Victoria/4897/2022 gerichtetem Frettchenimmunserum. Rot, Geometrisches Mittel der Positivkontrollen (homologe Reaktion gegen das Impfstammvirus); blau, Reaktivität der Isolate; grün Bereich von 2 log2 um den Mittelwert der Positivkontrollen = Bereich optimaler Passgenauigkeit in Bezug zum Impfstamm. Quelle: RKI

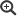
Abb. 3: Reaktivität isolierter A(H3N2)-Influenzaviren mit gegen den Impfstamm A/Darwin/9/2021 gerichtetem Frettchenimmunserum. Rot, Geometrisches Mittel der Positivkontrollen (homologe Reaktion gegen den Impfstamm); blau, Reaktivität der Isolate; grün Bereich von 2 log2 um den Mittelwert der Positivkontrollen = Bereich optimaler Passgenauigkeit in Bezug zum Impfstamm.. Quelle: RKI

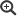
Abb. 4: Reaktivität isolierter B/Victoria-Influenzaviren mit gegen den Impfstamm B/Austria/1359417/2021 gerichtetem Frettchenimmunserum. Rot, Geometrisches Mittel der Positivkontrollen (homologe Reaktion gegen den Impfstamm); blau, Reaktivität der Isolate; grün Bereich von 2 log2 um den Mittelwert der Positivkontrollen = Bereich optimaler Passgenauigkeit in Bezug zum Impfstamm. Quelle: RKI
nach oben
Resistenzanalyse der Influenzaviren
Die Untersuchung der Empfindlichkeit zirkulierender Influenzaviren gegenüber antiviralen Medikamenten zeigte eine vollständige Resistenz der Influenza A-Viren gegenüber Amantadin und Rimantadin (348 A(H1N1)pdm09, 31 A(H3N2) Viren wurden untersucht).
Gegenüber den Neuraminidasehemmern Oseltamivir und Zanamivir blieben sowohl Influenza A- als auch Influenza B-Viren empfindlich (327 phänotypisch, 441 genotypisch, 104 genotypisch und phänotypisch untersucht).
Darüber hinaus zeigte die genotypische Analyse von 374 Viren (319 A(H1N1)pdm09, 29 A(H3N2) und 26 BVic) keine Mutation, die mit einer Resistenz gegen Baloxavir marboxil, dem Inhibitor der Cap-abhängigen Polymerase, assoziiert ist.
nach oben
Zirkulation respiratorischer Viren
Die Saison 2023/24 war bei den Influenzaviren durch eine frühzeitige und starke A(H1N1)pdm09-Welle charakterisiert, an die sich eine schwache Welle der Zirkulation von B/Victoria Viren anschloss (Abb. 5). Die RSV-Welle war weniger stark als in den letzten Saisons und endete in KW10 2024 (Abb. 6). SARS-CoV-2 wurden von KW34-52 2023 regelmäßig mit Positivenraten >15% im ARE-Praxis-Sentinel nachgewiesen; seit KW1 2024 gingen die Positivenraten zurück und stiegen ab KW25 2024 wieder an (Abb. 7).

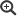
Abb. 5: Zirkulation von Influenzaviren von der letzten präpandemischen Saison ab KW40 2019 bis KW35 2024 (ARE-Praxis-Sentinel) Quelle: RKI

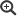
Abb. 6: Zirkulation von Rhinoviren (HRV), Parainfluenzaviren (PIV), Humanen Metapneumoviren (HMPV) und Respiratorischen Synzytialviren (RSV) von der letzten präpandemischen Saison ab KW40 2019 bis KW35 2024 (ARE-Praxis-Sentinel) Quelle: RKI

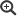
Abb. 7: Zirkulation von SARS-CoV-2 und endemischen Coronaviren (229E, HKU1, OC43, NL63) von der letzten präpandemischen Saison ab KW40 2019 bis KW35 2024 (ARE-Praxis-Sentinel) Quelle: RKI
nach oben
Surveillance schwerer akuter respiratorischer Infektionen
Neben dem virologischen Sentinel im ambulanten Bereich werden auch Proben von stationär aufgenommenen Patienten untersucht. Die Wellen der Zirkulation von Influenzaviren (Abb. 8), von RSV (Abb. 9) und SARS-CoV-2 reflektierten sich auch im stationären Bereich (Abb. 10). Darüber hinaus wurden auch HRV, PIV und HMPV bei hospitalisierten Patienten nachgewiesen (Abb. 9).

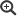
Abb. 8: Nachweis von Influenzaviren von KW40 2023 bis KW35 2024 (SARI-Sentinel) Quelle: RKI

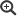
Abb. 9: Nachweise von Rhinoviren (HRV), Parainfluenzaviren (PIV), Humanen Metapneumoviren (HMPV) und Respiratorischen Synzytialviren (RSV) von KW40 2023 bis KW35 2024 (SARI-Sentinel) Quelle: RKI

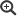
Abb. 10: Nachweise von SARS-CoV-2 und endemischen Coronaviren (229E, HKU1, OC43, NL63) von KW40 2023 bis KW35 2024 (SARI-Sentinel) Quelle: RKI
nach oben